前言
a. 高靈敏度的免疫試劑
為了不浪費珍貴的實驗動物樣本並發揮其最大的價值,應選擇高靈敏、高精準度的免疫試劑來進行分析,以提高實驗的準確性與可信度。而 ELISpot 從單細胞層面進行分析,可在數十萬顆細胞中檢測單顆細胞的免疫反應。
b. Mabtech 免疫試劑適用不同物種的動物模型
Mabtech 提供不同物種的 IFN-γ ELISpot 試劑,包含:雪貂、倉鼠、土撥鼠等,可分析特定人類疾病動物模型的免疫反應,有助於藥物或疫苗的研發。
c. 為什麼分析 IFN-γ ?
IFN-γ 為一種促炎細胞因子,主要由活化的 T 細胞和 NK 細胞所分泌。 IFN-γ 可激活巨噬細胞和內皮細胞,也可影響 T 細胞、B 細胞與抗原呈現細胞 (APC) 以調節免疫反應。輔助型 T 細胞和胞殺型 T 細胞所分泌的 IFN-γ 為 TH1 表型的重要標誌,故高水平的 IFN-γ 通常與宿主對病原體的有效防禦相關。
選擇合適的動物模型
選擇實驗動物時應優先考慮動物物種的進化程度,且盡可能選擇結構、功能、代謝與人類相近的動物進行實驗。研究者在選擇實驗動物前,除了充分瞭解實驗動物的生物學特徵,其在感染人類疾病時可否產生相似的病徵也需要進一步瞭解,以避免資源的浪費[1]。

應用實例
a-1. 雪貂 Ferret 與流感
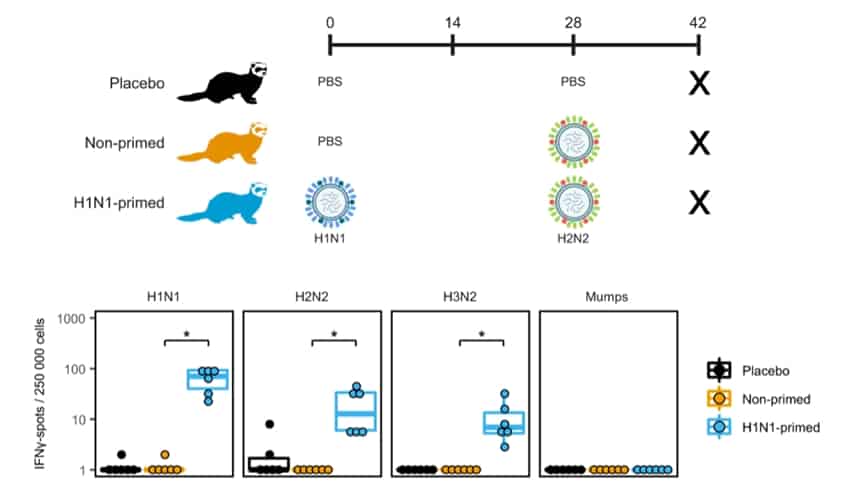
雪貂感染流感後產生的臨床病徵、病理現象及免疫反應與人類非常相似,是到目前為止被認為是對流感病毒反應最佳、研究人類流感病毒最理想的小型動物模式[2]。
Koen van de Ven等人在文中提到,雖然最常以小鼠模型研究 T 細胞反應,但小鼠不會表現出流感的傳統疾病症狀(發燒、打噴嚏等),且不易感染人流感病毒。相比之下,雪貂更適合作為流感研究用的動物模型,不僅可改善小鼠和人類研究間的差距,更促進流感疫苗的開發。
下圖為作者利用 MabTech Ferret IFN-γ ELISpot 分析雪貂感染不同流感病毒亞型後的 T 細胞免疫反應[3] 。
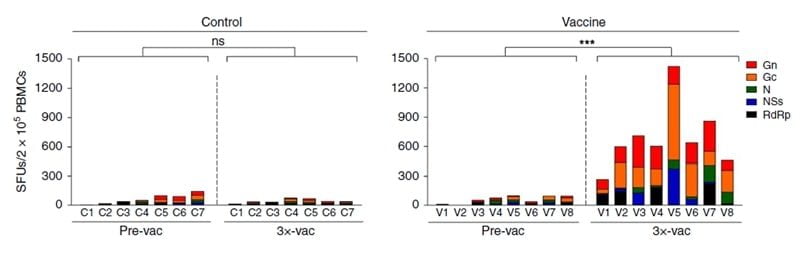
a-2. 雪貂 Ferret 與SFTS
雪貂除了可用於流感病毒的研究外,Kwak, JE 等人在開發發熱伴血小板減少綜合症(SFTS) 的DNA疫苗時,以老年雪貂作為動物模型,模擬人類感染 SFTSV 的臨床病徵,例如嚴重的血小板減少症、白血球減少、高燒和高死亡率。
下圖為使用MabTech Ferrets IFN-γ ELISpot 分析雪貂施打疫苗後的特異性 T 細胞的免疫反應[4]。
b. 倉鼠 Hamsters 與 COVID-19
新型冠狀病毒透過表面的S蛋白與人類受體ACE2結合進而感染人體,雖然恆河猴與絨猴和人類最相似,但以非人類靈長類動物進行研究,所需的資金及環境要求相當嚴格。
港大醫學院陳福和助理教授團隊發現金黃敘利亞倉鼠 (Golden Syrian Hamster)的ACE2與人類僅差4個氨基酸,並且可被 SARS-CoV-2感染,可作為模擬人體感染進程的動物模型 [5]。
近期國衛院研發新冠肺炎(COVID-19) DNA疫苗,以倉鼠進行疫苗免疫效力試驗,觀察倉鼠施打疫苗後,對於新冠病毒的感染是否具有保護力[6]。
c. 土撥鼠 Woodchuck 與 B型肝炎
全球有將近三億五千萬人為慢性 B 型肝炎病毒帶原者,其中每年大約有一百萬人死於併發症,為十大死因之一。土撥鼠對於土撥鼠肝炎病毒(Woodchuck hepatitis virus; WHV)具有感受性,此病毒與人類 B 型肝炎病毒的基因結構和複製機轉相近,而土撥鼠感染WHV病毒後也會發展成肝癌。因此,將土撥鼠作為研究人類 B 型肝炎病毒及病毒誘發肝細胞癌的自發性動物模型[7]。台大吳慧琳研究團隊於2010年以土撥鼠肝癌動物模型,進行基因治療後土撥鼠肝腫瘤大幅縮小80-90%[8]。
參考資料
-
van de Ven, K., de Heij, F., van Dijken, H. et al. Systemic and respiratory T-cells induced by seasonal H1N1 influenza protect against pandemic H2N2 in ferrets. Commun Biol 3, 564 (2020).
-
Kwak, JE., Kim, YI., Park, SJ. et al. Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets. Nat Commun 10, 3836 (2019).
-
Sia S.F. et al. Pathogenesis and transmission of SARS-CoV-2 in golden hamsters. Nature 583, 834–838 (2020)
-
Lanford, R.E., Chavez, D., Brasky, K., Burns, R., and Rico-Hesse, R. Isolation of a newhepadnavirus from the woolly monkey, a New World primate. Proc. Natl. Acad. Sci. USA 95, 5757-5761. (1998).
-
Wu, H.-L., et al (2010). Combining antiangiogenic therapy with immunotherapy exerts better therapeutical effects on large tumors in a woodchuck hepatoma model. Proceedings of the National Academy of Sciences, 107(33), 14769–14774.









![[新品上市] ELISA PathRF – 有效消除類風濕因子和嗜異性抗體所造成的偽陽性訊號](https://biocommander.com/wp-content/uploads/2022/03/ELISA-PathRF-500x383.png)

![[新品上市]提高準確 TB 診斷,杜絕結核傳染](https://biocommander.com/wp-content/uploads/2021/12/TB-文章-500x383.png)
![[新品上市] 世翔提供從研究到藥物/疫苗開發 COVID-19 的免疫試劑](https://biocommander.com/wp-content/uploads/2021/07/post-2455-01-500x383.png)
![[新品上市] KOKEN AteloCell® Honeycomb 能直接放進老鼠體內的3D培養細胞](https://biocommander.com/wp-content/uploads/2021/07/Cover-3d-culture-koken-honeycomb-500x383.png)
![[新品上市] TdB 提供葡聚醣和聚蔗糖衍生物 GPC 分析](https://biocommander.com/wp-content/uploads/2021/07/Cover-TdB-GPC-analysis-500x383.png)
![[新品上市] 3D 影像判讀於ELISPOT / FluoroSpot分析優勢](https://biocommander.com/wp-content/uploads/2021/07/post-2383-01-500x383.jpg)



![[新品上市] StemRNA Reprogramming system Introduction](https://biocommander.com/wp-content/uploads/2021/07/StemRNA-Reprogramming-system-Introduction-500x383.png)